ตัวเร่งปฏิกิริยา ซัลไฟต์ออกซิเดส ทำให้เกิดการเปลี่ยนสารประกอบกำมะถันที่เป็นพิษจากการสลายกรดอะมิโนเป็นซัลเฟตที่ไม่เป็นพิษ
มีความสำคัญและเกิดขึ้นในสิ่งมีชีวิตทุกชนิด หากการทำงานของมันถูกรบกวนโดยความบกพร่องทางพันธุกรรมการขาดซัลไฟต์ออกซิเดสจะเกิดขึ้น ปริมาณซัลไฟต์ที่สูงเกินไปในเลือดอาจส่งผลเสียต่อผู้ป่วยที่มีสุขภาพดี
ซัลไฟต์ออกซิเดสคืออะไร?
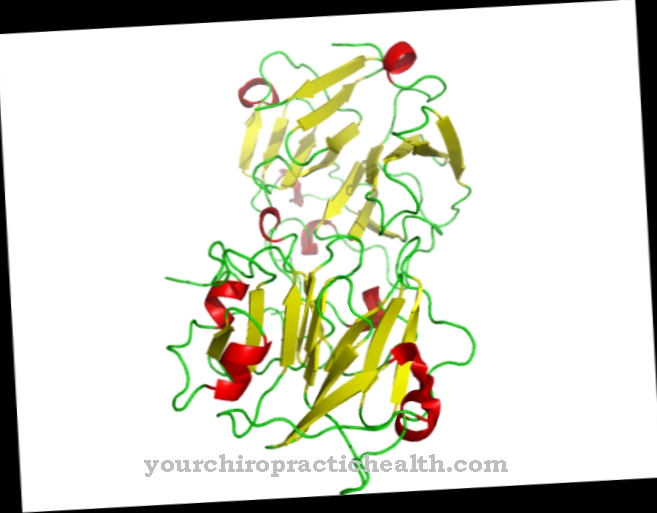
ซัลไฟต์ออกซิเดส (ชื่อยีน: SUOX) เป็นชื่อของเอนไซม์ที่ประกอบด้วยโมลิบดีนัมซึ่งประกอบด้วยกรดอะมิโน 466 ชนิด มันเป็นของครอบครัวของ xanthine dehydrogenases และเกิดขึ้นในสิ่งมีชีวิตเกือบทั้งหมด ประกอบด้วยโมลิบดีนัมซึ่งเป็นธาตุที่สำคัญอยู่ตรงกลาง
โลหะเกิดขึ้นที่นั่นในรูปแบบที่สามารถใช้งานทางชีวภาพได้ในรูปของประจุลบโมลิบเดต ซัลไฟต์ออกซิเดสใช้เป็นโคแฟกเตอร์ (สารประกอบโมลิบเดต - โมลิบโดรเทอริน) เอนไซม์จะแปลงกรดอะมิโนเมไทโอนีนที่มีกำมะถันซิสเทอีน ฯลฯ ซึ่งกินเข้าไปทางอาหารให้เป็นเกลือกำมะถัน (ซัลเฟต) ที่ไม่เป็นอันตรายซึ่งจะถูกขับออกทางปัสสาวะ ในสัตว์เลี้ยงลูกด้วยนม biocatalyst ที่ย่อยสลายกำมะถันส่วนใหญ่เกิดขึ้นที่ตับและไต เอนไซม์ซัลไฟต์ออกซิเดสช่วยให้มั่นใจได้ว่าออกซิเจนในเลือดรวมตัวกับกรดอะมิโนที่จำเป็นและสารกำมะถันอื่น ๆ
อิเล็กตรอนที่ปล่อยออกมาในกระบวนการนี้จะใช้ในการผลิต ATP (adenosine triphosphate) ผ่านห่วงโซ่การขนส่งอิเล็กตรอน เอนไซม์เร่งปฏิกิริยา 10 เท่าของปริมาณซัลไฟต์ที่พบในแอลกอฮอล์หนึ่งลิตรทุกวัน
ฟังก์ชันเอฟเฟกต์และงาน
ทุกคนบริโภคโปรตีนที่มีกำมะถันและวัตถุเจือปนอาหารเป็นประจำทุกวัน หลังมีอยู่ในผักดองน้ำเกรพฟรุต ฯลฯ และมีไว้เพื่อป้องกันอาหารจากการเข้าทำลายของจุลินทรีย์และการเปลี่ยนสี พวกมันสร้างสารช่อดอกไม้ในไวน์
การสลายซีสเตอีนเพียงอย่างเดียวส่งผลให้สารซัลไฟต์ที่เป็นพิษในร่างกาย 1680 มก. ทุกวันซึ่งซัลไฟต์ออกซิเดสจะต้องเปลี่ยนทันทีเพื่อไม่ให้อวัยวะและเนื้อเยื่อเสียหาย เอนไซม์ทำงานร่วมกับตัวเร่งปฏิกิริยาทางชีวภาพอื่น ๆ ซัลไฟต์เป็นพิษและสามารถทำลายสารสำคัญในร่างกายและยับยั้งกระบวนการเผาผลาญที่จำเป็นแม้ในปริมาณที่น้อยที่สุด เพื่อให้สามารถทำการล้างพิษที่สำคัญของเซลล์ได้ซัลไฟต์ออกซิเดสต้องการโมลิบดีนัมธาตุ
การขาดแคลนโลหะนี้อาจส่งผลร้ายแรง ระดับปรอทในร่างกายที่สูงเกินไปสามารถยับยั้งการทำงานของซัลไฟต์ออกซิเดส
การศึกษาการเกิดคุณสมบัติและค่าที่เหมาะสม
ซัลไฟต์ออกซิเดสส่วนใหญ่ผลิตในไมโทคอนเดรียซึ่งเป็น "ศูนย์พลังงาน" ของเซลล์ ตัวอย่างเช่นในหนู 80 เปอร์เซ็นต์เกิดในไมโทคอนเดรียของเซลล์ตับ นอกจากนี้มันยังแสดงอย่างมากในเซลล์ของไต
โมลิบดีนัมออกไซด์ที่จำเป็นสำหรับการทำงานของซัลไฟต์ออกซิเดสตั้งอยู่ในศูนย์กลางที่ใช้งานของเอนไซม์ ดังที่นักวิทยาศาสตร์เพิ่งค้นพบอนุภาคนาโนโมลิบดีนัมไตรออกไซด์สามารถแทนที่ได้ในผู้ป่วยที่มีภาวะขาดโมลิบดีนัม พวกมันมีฤทธิ์เร่งปฏิกิริยาในร่างกายเช่นเดียวกับเอนไซม์ตามธรรมชาติ ด้วยวิธีนี้สามารถรักษาโรคร้ายแรงเช่นซัลโฟซิสไตนูเรียได้
โรคและความผิดปกติ
การขาดซัลไฟต์ออกซิเดสอาจทำให้เกิดอาการหืดและแม้แต่ปฏิกิริยาอะนาไฟแล็กติกในคนที่มีสุขภาพดีเนื่องจากระบบประสาทกระซิกมีผลต่อเซลล์มาสต์ที่รับผิดชอบต่อการเกิดโรคภูมิแพ้
นอกจากนี้หากระดับซัลไฟต์ออกซิเดสต่ำเกินไปอาจทำให้เกิดอาการเหนื่อยง่ายปวดศีรษะและระดับน้ำตาลในเลือดต่ำ การขาดพันธุกรรมในเอนไซม์ที่สำคัญยิ่งส่งผลร้าย ทารกแรกเกิดเกิดมาพร้อมกับความพิการทางร่างกายและความพิการทางจิต สิ่งนี้เรียกว่าการขาดซัลไฟต์ออกซิเดสหรือซัลโฟซิสไตนูเรียเกิดขึ้นเมื่อเป็นโรคขาดปัจจัยร่วมโมลิบดีนัม (MoCo) ในการเกิดประมาณ 100,000 ถึง 500,000 ครั้ง ทารกที่ทุกข์ทรมานจากข้อบกพร่องของซัลไฟต์ออกซิเดสที่แยกได้จะแสดงอาการคล้าย ๆ กันคือสมองอักเสบรุนแรงอาการชักที่ควบคุมแทบไม่ได้อาการเกร็งไมโครซีฟาลีการคลายกล้ามเนื้อและการฝ่อของสมองที่ก้าวหน้า
เนื่องจากปัจจุบันไม่สามารถรักษาโรคขาดเอนไซม์ที่ถ่ายทอดทางพันธุกรรมแบบถอยโดยอัตโนมัติได้อย่างมีประสิทธิภาพผู้ป่วยรายย่อยมักจะเสียชีวิตในวัยเด็ก ได้แก่ สารประกอบกำมะถันที่ไม่สลายเซลล์ประสาทที่เป็นพิษและปลอกไมอีลินของระบบประสาทส่วนกลางและสะสมในเนื้อเยื่อของเซลล์ หลังคลอดมีปัญหาในการรับประทานอาหารและอาเจียนในกระเพาะอาหาร ทารกเกิดมาพร้อมกับกะโหลกศีรษะที่ผิดรูป (หน้าผากยื่นออกมาตาลึกเปลือกตายาวมากริมฝีปากหนาจมูกเล็ก) ในช่วงหลายเดือนแรกของชีวิตเลนส์จะเลื่อนไปในดวงตา
ประมาณ 75 เปอร์เซ็นต์ของกรณีของ sulfocysteinuria ที่อธิบายไว้จนถึงตอนนี้เกิดจากการขาด MoCo: เอนไซม์ทั้งสามที่เกี่ยวข้องกับการสลายกำมะถันในร่างกาย, ซัลไฟต์ออกซิเดส, แซนไทน์ออกซิเดสและอัลดีไฮด์ออกซิเดสแสดงกิจกรรมที่ลดลงอย่างมาก สาเหตุของการขาดซัลไฟต์ออกซิเดสที่แยกได้คือการกลายพันธุ์ในยีน SUOX (โครโมโซม 12) ปรากฏในสามสายพันธุ์: ประเภท A (การกลายพันธุ์ในยีน MOCS1) ประเภท B (ยีน MOCS2) และประเภท C (ยีน MOCS3) การกลายพันธุ์แบบ A พบมากที่สุด การก่อตัวของโมเลกุลของสารตั้งต้น cPMP ถูกยับยั้ง อย่างไรก็ตามขณะนี้สามารถผลิตและบริหารสารในห้องปฏิบัติการได้เพื่อปรับปรุงระยะเวลาการรอดชีวิตของผู้ป่วยเด็กควรได้รับการวินิจฉัยโรคขาดโดยเร็วที่สุดและรับการรักษาด้วยการให้โมลิบเดตทางหลอดเลือดดำทุกวัน
ด้วยวิธีนี้อย่างน้อยก็สามารถป้องกันความเสียหายเพิ่มเติมได้ เด็กจะได้รับยา antispasmodic เพื่อต่อสู้กับอาการชัก นอกจากนี้ยังต้องรับประทานอาหารที่มีโปรตีนต่ำ นอกจากนี้ยังสามารถใช้สารตั้งต้น MoCo Z ช่วยลดอาการชักและป้องกันความเสียหายของสมองเพิ่มเติม การแพทย์มีความหวังอย่างยิ่งในการรักษาโรคที่รักษาไม่หายก่อนหน้านี้ด้วยอนุภาคนาโนโมลิบดีนัมไตรออกไซด์ซึ่งมีบทบาทเป็นซัลไฟต์ออกซิเดสในร่างกาย หากต้องการทราบว่าเด็กในครรภ์มีภาวะขาดซัลไฟต์ออกซิเดสหรือไม่หญิงตั้งครรภ์สามารถตรวจระดับ S-sulfocysteine ในน้ำคร่ำได้







.jpg)


.jpg)






.jpg)